{loadnavigation}
თერმოდინამიკის პირველი კანონიდან გამომდინარე იზოთერმულ პროცესში, რომლის დროსაც შინაგანი ენერგია უცვლელი რჩება(\(\Delta U=0\)), აირის მიერ მიღებული სითბოს რაოდენობა Q სრულად გარდაიქმნება მუშაობად \(A\).
\(A=Q\)
მაგრამ სითბოს მუშაობად გარდაქმნის ასეთი ერთჯერადი აქტი ტექნიკისათვის საინტერესო არ არის. რეალურად არსებული სითბური ძრავები (ორთქლის მანქანები, შიგა წვის ძარავები და ა.შ.) ციკლურად მუშაობენ.თბოგადაცემისა და მიღებული სითბოს რაოდენობის მუშაობად გარდაქმნის პროცესი პერიუდულად მეორდება. ამისათვის მუშა სხეული უნდა ასრულებდესწრიულ პროცესს ანუ თერმოდინამიკურ ციკლს, რომლის დროსაც საწყისი მდგომარეობა პერიოდელად აღდგება. წრიული პროცესი აირადი მუშა სხეულის \((p,V)\) დიაგრამაზე გამოისახება ჩაკეტილი მრუდის სახით (ნახ. 1). გაფართოებისას აირი \(abc\) მრუდის ქვეშა ფართობის ტოლ დადებით მუშაობას \(A_{1}\) ასრულებს, შეკუმშვისას \(cda\) მრუდის ქვეშა ფართობის მოდულის ტოლ უარყოფით მუშაობას \(A_{2}\). \(A=A_{1}+A_{2}\) ციკლის განმავლობაში შესრულებული სრული მუშაობა დიაგრამაზე \((p,V)\) ციკლის ფართობის ტოლია. მუშაობა \(A\) დადებითია, თუ ციკლი საათის ისრის მიმართულებით მიმდინარეობს, და \(A\) უაროფითია თუ ციკლი საათის ისრის საწინააღმდეგოდ მიმდინარეობს.

ნახ. 1.
წრიული პროცესი \((p,V)\) დიაგრამაზე. \(abc\) – გაფართოების მრუდი, \(cda\)– შეკუმშვის მრუდი. \(A\) მუშაობა წრიულ პროცესში დოლია \(abcd\) ფართობის.
ყველა წრუილი პროცესის საერთო თვისება იმაში მდგომარეობს, რომ ისინი არ შეიძლება მიმდინარეობდნენ მუშა სხეულის მხოლოდ ერთ სითბურ რეზერვუართან სითბური კონტაქტის პირობებში. სითბური რეზერვუარი ორი მაინც უნდა იყოს. უფრო მაღალი ტემპერატირის მქონე სითბურ რეზერვუარს გამათბობელს უწოდებეს, ხოლო უფრო დაბალი ტემპერატურისას გამაციებელს. მუშა სხეული სითბური ციკლის შესრულების პროცესში გამათბობელიდან იღებს სითბოს გარკვეულ რაოდენობას \(Q_{1}>0\) და გადასცემს გამაციებელს \(Q_{2}<0\) სითბოს რაოდენობას. ამ ცოკლში მიღებული სითბოს სრული რაოდენობა ტოლია
\(Q=Q_{1}+Q_{2}=Q_{1}-|Q_{2}|.\)
ციკლის ბოლოს მუშა სხეული ბრუნდება საწყის მდგომარეობაში, ე.ი., მისი შინაგანი ენერგიის ცვლილება ნულის ტოლია (\(\Delta U=0\)). თერმოდინამიკის პირველი კანონის თანახმად,
\(\Delta U=Q-A=0.\)
აქედან გამოდის:
\(A=Q=Q_{1}-|Q_{2}|.\)
ციკლის განმავლობაში სხეულის მიერ შესრულებული მუშაობა A ამავე ციკლის განმავლობაში მიღებული სითბოს რაოდენობის \(Q_{1}\) ტოლია. \(A\) მუშაობის ფარდოდობას ციკლის განმავლობაში სხეულის მიერ გამახურებლიდან მიღებულ სითბოს რაოდენობასთან სითბური მანქანის მარგი ქმედების \(\eta\) კოეფიციენტს უწოდებენ:
\(\eta=\frac{A}{Q_{1}}=\frac{Q_{1}-|Q_{2}|}{Q_{1}}.\)
მარგი ქმედების კოეფიციენტი მიუთითებს მუშა სხეულის მიერ „ცხელი“ სითბური რეზერვუარიდან მიღებული სითბური ენერგიის რა ნაწილი გადაიქცა სასარგებლო მუშაობად. დანარჩენი ნაწილი (\(1-\eta\)) „უსარგებლოდ“ გადაეცა გამაციებელს.სითბური მანქანის მარგი ქმედების კოეფიციენტი ყოველთვის ერთზე ნაკლებია (\(\eta<1\)). სითბური მანქანის ენერგეტიკული სქემა მოცემულია ნახ. 2-ზე.

ნახ. 2.
სითბური მანქანის ენერგეტიკული სქემა: 1 - გამახურებელი; 2 - გამაციებელი; 3 - მუშა სხეული ციკლურ პოცესში. \(Q_{1}>0,A>0,Q_{2}<0;T_{1}>T_{2}\)
ტექნიკაში გამოყენებულ ძრავებში სხვადასხვა ციკლური პროცესები გამოიყენება. ნახ. 3-ზე ბენზინის კარბურატორსა და დიზელის ძარავებში გამოყენებული ციკლები. ორივე შემთხვევაში მუშა სხეულს ორთქლის ნაზავი - ბენზინის ან დიზელი ჰაერთან - გამოიყენება. შინაგანი წვის კარბურატორული ძრავის ციკლი შედგება ორი იზოქორისა (1–2, 3–4) და ორი ადიაბატისაგან (2–3, 4–1). შინაგანი წვის დიზელის ძრავა მუშაობს ციკლით რომელიც ორი ადიაბატისა (1–2, 3–4), ერთი იზობარისა (2–3) და ერთი ოზოქორისაგან (4–1) შედგება. მარგი ქმედების რეალური კოეფიციენტი კარბურატორული ძრავისათვის 30 %-ის რიგისაა, დიზელის ძრავისათვის კი - 40 % რიგის.

ნახ. 3.
შინაგანი წვის კარბურატორული ძრავის ციკლი (1) და დიზელის ძრავის ციკლი (2)
1824 წელს ფარაგმა ინჟინერმა ს.კარნომ ორი იზოთერმისა და ორი ადიაბატისაგან შედგენილი ციკლური პროცესი განიხილა, რამაც მნიშვნელოვანი როლი შეასრულა სითბური პროცესების შესწავლის განვითარებაში. იგი კარნოს ციკლის სახელწოდებითაა ცნობილი (ნახ. 4).

ნახ. 3.11.4.
კარნოს ციკლი
კარნოს ციკლს ასრულებს დგუშიან ცილინდრში მოთავსებული აირი. (1-2) იზოთერმულ უბანზე აირი შედის T1 ტაემპერატურის მქონე ცხელ სითბურ რეზერვუართან კონტაქტში (გამაცხელებელთან). აირი იზოტერმულად ფართოვდება და ასრულებს A12 მუშაობას, ამასთან აირს გადაეცემა სითბოს გარკვეული რაოდენობა Q1 = A12. შემდეგ ადიაბატურ უბანზე (2-3) აირი ექცევა ადიაბატურ გარსში და აგრძელებს გაფართოებას თბოგაცვლის გარეშე. ამ უბანზე აირი ასრულებს A23 > 0 მუშაობას. ადიაბატური პროცესისას აირის ტემპერატურა ეცემა T2 მნიშვნელობამდე. შემდეგ იზოთერმულ უბანზე (3-4) აირი შედის სითბურ კონტაქტში ცივ სითბურ რეზერვუართან (გამაციებელთან) T2 < T1. ხდება იზოთერმული შეკუმშვის პროცესი. აირი ასრულებს A34 < 0 მუშაობას და გასცემს სითბოს Q2 < 0 რომელიც შესრულებული A34 მუშაობის ტოლია. აირის შინაგანი ენერგია იცვლება. და ბოლოს, ადიაბატური შეკუმშვის ბოლო მონაკვეთზე აირი ისევ ადიაბატურ გარსში ექცევა. შეკუმშვისას აირის ტემპერატურა მატულობს T1 მნიშვნელობამდე და აირი ასრულებს A41 < 0 მუშაობას. ციკლის განმავლობაში აირის მიერ შესრულებული სრული მუშაობა A ტოლია, ცალკეულ მონაკვეთებზე შესრულებული მუშაობების ჯამისა:
A = A12 + A23 + A34 + A41
(p, V) დიაგრამაზე ეს მუშაობა ციკლის ფართობის ტოლია.
პროცესები კარნოს ციკლის ყველა უბანზე კვაზისტატისტიკურად ითვლება. კერძოდ, ორივე იზოთერმული უბანზე პროცესი მიმდინარეობს მუშა სხეულსა (იარი) და სითბურ რაზერვუარს (გამახცელებელი ან გამაციებელი) შორის უსასრულოდ მცირე ტემპერატურული სხვაობით.
თერმოდინამიკის პირველი კანონიდან გამომდინარე, ადიაბატური გაფართოებისას (ან შეკუმშვისას) აირის მუშაობა მისი შინაგანი ენერგიის ΔU დანაკარგის ტოლია. ერთი მოლი აირისათვის:
A = –ΔU = –CV (T2 – T1),
სადაც T1 და T2 - აირის საწყისი და საბოლოო ტემპერატურებია.
აქედან გამომდინარეეობს, რომ კარნოს ციკლის ორ ადიაბატურ უბანზე მუშაობა მოდულით ტოლი და სხვადასხვა ნიშნისაა.
A23 = –A41
განმარტების მიხედვით, კარნოს ციკლისას მარგი ქმედების კოეფიციენტი ტოლია
\(\eta=\frac{A}{Q_{1}}=\frac{A_{12}+A_{34}}{Q_{1}}=\frac{Q_{1}-|Q_{2}|}{Q_{1}}=1-\frac{|Q_{2}|}{Q_{1}}.\)
კარნომ ციკლის მარგი ქმედების კოეფიციენტი გამოსახა გაცხელების T1 და გაციების T2 ტემპერატურაების საშუალებით:
\(\eta=\frac{T_{1}-T_{2}}{T_{1}}=1-\frac{T_{2}}{T_{1}}.\)
კარნოს ციკლი იმითაა მნიშვნელოვანი, რომ მის არცერთ მონაკვეთზე არ გვაქვს სხვადასხვა ტემპერატურის სხეულების ურთიერთშეხება. ციკლის განმავლობაში მუშა სხეულის (აირის) ნებისმიერი მდგომარეობა კვაზიწონასწორულია, ე.ი. გარემომცველ სხეულებთან (სითბურ რაზერვუარებთან და თერმოსტატებთან) სითბურ წონასწორობაში ყოფნასთან უსასრულოდ ახლოს. კარნოს ციკლი გამორიცხავს ციკლის განმავლობაში მუშა სხეულსა და გარემომცველ სხეულებს (თერმოსტატებს) შორის სასრული ტემპერატურათა სხვაობის პირობებში სითბო გადაეცემოდეს მუშაობის შესრულების გარეშე. ამიტომ კარნოს ციკლი - ყველაზე ეფექტური წრიული პროცესია განსაზღვრული ტემპერეტურების მქონე გამაცხელებლისა და გამაციებლისათვის ყველა შესაძლო პროცესებს შორის.
Ηკარნო = ηmax.
კარნოს ციკლის ნებისმიერი უბანი და მთელი ციკლი შეიძლება გავლილი იქნეს ორივე მიმართულებით. ციკლის შემოვლა საათის მიმათულებით შეესაბამება სითბურ ძრავას, როცა მუშა სხეულის მიერ მიღებული სითბო ნაწილობრივ სასარგებლო მუშაობად გარდაიქმნება. საათის საწინააღმდეგოდ შემოვლა შეესაბამება გამაციებელ მანქანებს, როცა გარე მუშაობის ხარჯზე სითბოს გარკვეული რაოდენობა ცივი რეზერვუარიდან გადაეცემა ცხელ რეზერვუარს. ამიტომ,კარნოს ციკლოთ მომუშავე იდეალური მოწყობილობებს შექცევად სითბურ მანქანებს უწოდებენ.
რეალურ გამაციებელ მანქანებში სხვადასხვაგვარი ციკლური პროცესები გამოიყევება, ყველა გამაციებელი ციკლი (p, V) დიაგრამაზე საათის ისრის საწინააღმდეგოდ მემოივლის. გამაციებელი მანქანების ენერგეტიკული სქემა ნახ. 5-ზეა მოცემული.

ნახ. 5.
გამაციებელი მანქავების ენერგეტიკული სქემა. Q1 < 0,A < 0, Q2 > 0, T1 > T2
გამაციებელი ციკლით მომუშავე მოწყობილობას შეიძლება ჰქონდეს ორგვარი დანიშნულება. თუ სასარგებლო ეფექტს წარმოადგენს სითბოს გარკვეული რაოდენობის |Q2| წაღება გასაციებელი სხეულიდან (მაგ. მაცივრის კამერაში პროდუქტებიდან), მაშინ ასეთი მოწყობილობა ჩვეულებრივი მაცივარია. მაცივრის მუშაობის ეფექტურობა შეიძლება დახასიათდეს ფარდობით:
\(\beta_{x}=\frac{|Q_{2}|}{|A|},\)
ე.ი. მაცივრის მუშაობის ეფექტურობა სითბოს ის რაოდენობაა რომელიც ერთი ჯოული დახარჯული მუშაობის შედეგად გაიცემა გასაციებელი სხეულის მიერ. ასეთი განმარტების შემთხვევაში βх შიეძლება იყოს ერთზე მეტიც და ნაკლებიც. კარნოს ციკლის შექცეული პროცესის დროს
\(\beta_{x}=\frac{T_{2}}{T_{1}-T_{2}}.\)
თუ სასარგებლო ეფექტს წარმოადგენს სითბოს გარკვეული |Q1| რაოდენობის გადაცემა გასაცხელებელი სხეულისთვის (მაგ., შენობაში ჰაერისთვის), მაშინ ასეთ მოწყობილობას სითბურ ტუმბოს უწოდებენ. სითბური ტუმბოს ეფექტურობა განისაზღვრება ფარდობით
\(\beta_{T}=\frac{|Q_{1}|}{|A|}\)
ე.ი. სითბოს რაოდენობა , რომელიც უფრო თბილ სხეულს გადაეცემა ერთი ჯოული მუშაობის დახარჯვის შედეგად. თერმოდინამიკის პირველი კანონოდან გამოდის:
|Q1| > |A|,
ე.ი., βТ ყოველთვის მეტია ერთზე. კარნოს შექცეული ციკლისათვის:
\(\beta_{T}=\frac{1}{\eta}=\frac{T_{1}}{T_{1}-T_{2}}.\)
{loadnavigation}
თუ თბოგაცვლის შედეგად სხეულს გადაეცემა სითბოს გარკვეული რაოდენობა, მასში სხეულის შინაგანი ენერგია და ტემპერატურა იცვლება. ერთი კგ ნივთიერების \(1K\) გასათბობად საჭირო სითბოს \(Q\) რაოდენობას ნივთიერების კუთრი სითბოტევადობა \(c\) ეწოდება.
\(c=Q/(m\Delta T)\)
ხშირად მოსახერხებელია მოლური სითბოტევადობის \(C\) ხმარება:
\(c=M\cdot c\)
სადაც, \(M\) - ნივთიერების მოლური მასაა.
ამგვარად განსაზღვრული სითბოტევადობა არ წარმოადგენს ნივთიერების უნიკალურ (ცალსახა) მახასიათებელს. თერმოდინამიკის პირველი კანონის თანახმად სხეულის შინაგანი ენერგიის ცვლილება დამოკიდებულია არა მარტო მიღებულ სითბოს რაოდენობაზე, არამედ სხეულის მიერ შესრულებულ მუშაობაზეც. იმის მიხედვით თუ რა პირობებში ხირციელდება თბოგაცვლის პროცესი, სხეულს სხვადასხვა მუშაობის შესრულება შეუძლია. ამიტომ სხეულისადმი გადაცემულ სითბოს ერთიდაიგივე რაოდენობას, შეეძლო გამოეწვია მისი შინაგანი ენერგიის და ე.ი. ტემპერატურის სხვადსხვაგვარი ცვლილება.
სითბოტევადობის ასეთი არაცალსახა განსაზღვრა მხოლოდ აირადი ნივთიერებებისათვისაა დამახასიათებელი. თხევადი და მყარი სხეულების გათბობისას მათი მოცულობა პრაქტიკულად არ იცვლება, და გაფართოების მუშაობა ნულის ტოლად შეიძლება ჩაითვალოს. ამითომ სხეულის მიერ მიღებული სითბოს სრული რაოდენობა მისი შინაგანი ენერგიის ცვლილებაზე მიდის. სითხეებისა და მყარი სხეულებისაგან განსხვავებით, აირებს სითბოგადაცემის პროცესში შეუძლია მნიშვნელოვნად შეიცვალოს მოცულობა და შეასრულოს მუშაობა. ამიტომაც აირადი ნივთიერების სითბოტევადობა თერმოდინამიკური პროცესის ხასიათზეა დამოკიდებული.ძირითადად განიხილება აირების სითბოტევადობის ორი მნიშვნელობა: CV – მოლური სითბოტევადობა იზოქორულ (V = const) პროცესებში და Cp – მოლური სითბოტევადობა (p = const) იზობარულ პროცესებში.
მუდმივი მოცულობის პროცესებში აირი მუშაობას არ ასრულებს: : A = 0. თერმოდინამიკის პირველი კანონიდან 1 მოლი აირისათვის
\(Q_{V}=C_{V}\Delta T=\Delta U.\)
შინაგანი ენერგიის \(\Delta U\) ცვლილება პირდაპირპროპორციულია ტემპერატურის \(\Delta T\) ცვლილებისა.
მუდმივიწნევის პროცესებისათვის თერმოდინამიკის პირველი კანონი იძლევა:
\(Q_{p}=\Delta U+p(V_{2}-V_{1})=C_{V}\Delta T+p\Delta V,\)
სადაც ΔV – 1 მოლო იდეალური აირის მოცულობის ცვლილებაა მისი ტემპერატურის ΔT ცვლილებისას. აქედან გამოდის:
\(C_{p}=\frac{Q_{p}}{\Delta T}=C_{V}+p\frac{\Delta V}{\Delta T}.\)
ფარდობა შეიძლება გამოითვალოს 1 მოლისათვის იდეალური აირის მდგომარეობის განტოლებიდან
\(pV=RT\)
სადაც \(R\) – აირის უნივერსალური მუდმივაა. როცა \(p=const\)
\(p\Delta V=R\Delta T\) ან \(\frac{\Delta V}{\Delta T}=\frac{R}{p}.\)
ამგვარად, გამოსახულებას, რომელიც \(C_{p}\) და \(C_{V}\) მოლურ სითბოტევადობებს შორის კავშირს გამოსახავს აქვს სახე (მაიერის ფორმულა):
\(C_{p}=C_{V}+R.\)
მუდმივი წნევის პროცესის აირის მოლური სითბოტევადობა \(C_{p}\) ყოველთვის ჭარბობს მუდმივი მოცულობის პროცესის \(C_{V}\)მოლურ სითბოტევადობას (ნახ. 1).

ნახ.1.
სხეულის ΔT = T2 – T1 გათბობის ორი შესაძლო პროცესი. p = const აირი ასრულებს A = p1(V2 – V1 ). მუშაობას. ამიტომ Cp > CV
მუდმივი წნევის და მუდმივი მოცულობის პროცესების სითბოტევადობების ფარდობა თერმოდინამიკაში მნიშვნელოვან როლა ასრულებს. ის \(\gamma\)-თი აღინიშნება.
\(\gamma=\frac{C_{p}}{C_{V}}\)
ერძოდ ეს ფარდობა შედის ადიაბატური პროცესების ფორმულებში.
დიაგრამაზე (p, V) T1 და T2 ტემპერატურის ორ იზოთერმას შორის გადასვლის სხვადასხვა გზაა შესაძლებელი. რადგანაც ყოველი ასეთი გადასვლისას ტემპერატურის ცვლილება ΔT = T2 – T1 ერთნაირია, შინაგანი ენერგიის ცვლილებაც ΔU ერთნაირია. მაგრამ, ამ დროს შესრულებული მუშაობა A და თბოგაცვლის შედეგად მიღებული სითბოს რაოდენობა სხვადასხვა გზის შემთხვევაში სხვადასხვა აღმოჩნდება. აქედან გამოდის, რომ აირს უსასრულოდ ბევრი სითბოტევადობა აქვს. Cp და CV – სითბოტევადობების მხოლოდ კერძო მნიშვნელობებია (და ძალიან მნიშვნელოვანი აირთა თეორიისათვის).
თერმოდინამიკურ პროცესებს, რომლებშიც აირის სითბოტევედობა უცვლელი რჩება პოლიტროპულს უწოდებენ. ყველა იზოპროცესი პოლიტროპყლია. იზოთერმული პროცესის შემთხვევაში ΔT = 0, ამიტომ CT = ∞. ადიაბატურ პროცესში ΔQ = 0, ე.ი. Cад = 0.
უნდა აღინიშნოს, რომ „სითბოტევადობა“, ისევე როგორც „სითბოს რაოდენობა“ - უკიდურესად გაუმართლებელი ტერმინებია. ისინი თანამედროვე მეცნიერებამ მემკვიდრეობით მიიღო XVIII საუკუნეში გაბატონებული სითბომბადის თეორიიდან. ეს თეორია სითბოს დამოუკიდებელ, განსაკუთრებული ნვთიერებად თვლიდა, რომელსაც სხეულები შეიცავდენ. ითვლიბოდა რომ ამ ნივთიერების როგორც შქმნა, ასევე განადგურება შეუძლებელი იყო. სხეულის გათბობა იხსნებოდა სხეულის შიგნით სითბომბადის მომატებით, გაციება კი შემცირებით. სითბომბადის თეორიამ ვერ ახსნა როგორ შეიძლება სხეულის შინაგანი ენერგიის ერთიდაიგივე ცვლილება მივიღოთ სხეულზე დახარჯული მუშაობაზე დამოკიდებულებით, მისთვის სხვადასხვა რაოდენობის სითბოს გადაცემით. ამიტომ ფიზიკურ აზრს მოკლებულია გამოთქმა: „მოცემული სხეული შეიცავს სითბოს გარკვეულ მარაგს“.
მოლეკულარულ-კინეტიკური თეორია მოლეკულების გადატანითი მოძრაობის საშუალო კინეტიკურ ენერგიასა \(\vec{E}\) და აბსოლუტურ ტმპერატურას \(T\) შორის შემდეგ კავშირს ადგენს:
\(\vec{E}=\frac{3}{2}kT.\)
1 მოლო იდეალური აირის შინაგანი ენერგია \(\vec{E}\) ტოლია ნამრავლისა ავოგადროს რიცხვზე \(N_{A}\):
\(U=\frac{3}{2}kN_{A}T=\frac{3}{2}RT.\)
ΔT ტემპერატურის ცვლილებით შინაგანი ენერგია იცვლება სიდიდით
\(\Delta U=\frac{3}{2}R\Delta T=C_{V}\Delta T\)
ΔU და ΔT შორი პროპორციულობის კოეფიციენტი მუდმივი წნევის დროს CV სითბოტევადობისა ტოლია:
\(C_{V}=\frac{3}{2}R=12,47\) ჯ/მოლი კ.
ეს თანაფარდობა ექსპერიმენტალურად კარგად საბუთდება ერთ ატომიანი მოლეკულებისაგან შემდგარი აირებით (ჰელიუმი, ნეონი, არგონი). მაგრამ ორატომინი ( წყალბადი, აზოტო) და მრავალატომიანი ( ნახსირორჟანგი) აირებისათვის ექსპერიმენტალურ მონაცემებთან თანხმობას არ იძლევა. ამ შეუსაბამობის მიზეზი იმაში მდგომარეობს, რომ ორ- და მრავალატომიანი მოლეკულების საშუალო კინეტიკური ენერგია უნდა ითვალისწინებდეს არა მხოლოდ გადატანითი მოძრაიბის ენერგიას , არამედ მოლეკულების ბრუნვითი მოძრაობის ენერგიასაც.

ნახ. 2.
ორატომიანი მოლეკულის მოდელი. O წერთილი მოლეკულის მასათა ცენტრს ემთხვევა.
ნახ. 2-ზე ორატომიანი მოლეკულის მოდელია გამოსახული. მოლეკულას ხუთი დამოუკიდებელი მოძრაობის შესრულება შეუძლია: სამი გადატანითი მოძრაობა X, Y, Z ღერძების მიმართ და ორი ბრუნვითი X და Y ღერძების მიმართ.
ცდები უჩვენებენ. რომ Z ღერძის, რომელზეც მოლეკულის მასათა ცენტრი მდებარეობს, მიმართ ბრუნვა შეიძლება ხდებოდეს მხოლოდ ძალიან მაღალი ტემპერატურის შემთხვევაში. ჩვეულებრივი ტემპერატურებისთვის Z ღერძის მიმართ ბრუნვა არ ხდება, ისევე როგორც ერთატომიან აირებში. ყოველი დამოუკიდებელ მოძრაობას თავისუფლების ხარისხი ეწოდება. ამგვარად, ერთატომინ მოლეკულას აქვს სამი გადატანითი თავისუფლების ხარისხი, „ხისტ“ ორატომიან მოლეკულას აქვს 5 (3 გადატანითი და 2 ბრუნვითი) ხარისხი, მრავალატომიან მოლეკულას - 6 თავისუფლების ხარისხი (3 გადატანითი და 3 ბრუნვითი).
კლასიკურ სტატისტიკურ ფიზიკაში მტკიცდება თეორემა თავისუფლების ხარისხების მიხედვით ენერგიის თანაბარი განაწილების შესახებ:
თუ მოლეკულების სისტება T ტემპერატურის პირობებში სითბურ წონასწორობაში ინყოფება, მაშინ საშუალო კინეტიკური ენერგია თანაბრადაა განაწილებული თავისუფლების ყველა ხარისხს შორის და მოლეკულის ყოველი თავისუფლების ხარისხი ტოლია \(\frac{1}{2}kT.\)
ამ თეორემიდან გამოდის, რომ აირის მოლური Cp და CV სითბოტევადობები და მათი ფარდობა γ შეიძლება შემდეგი სახით ჩაიწეროს.
\(C_{V}=\frac{i}{2}R, C_{p}=C_{V}+R=\frac{i+2}{2}R, \gamma=\frac{C_{p}}{C_{V}}=\frac{i+2}{i},\)
სადაც i - აირის თავისუფლების ხარისხებია რიცხვია.
ერთატომიანი მოლეკულებისაგან შემდგარი აირებისათვის (i = 3)
\(C_{V}=\frac{3}{2}R, C_{p}=C_{V}+R=\frac{5}{2}R, \gamma=\frac{5}{3}=1,66.\)
ორატომიანი მოლეკულებისაგან შემდგარი აირებისათვის (i = 5)
\(C_{V}=\frac{5}{2}R, C_{p}=C_{V}+R=\frac{7}{2}R, \gamma=\frac{7}{5}=1,4.\)
მრავალატომიანი მოლეკულებისაგან შემდგარი აირებისათვის (i = 6)
\(C_{V}=3R, C_{p}=C_{V}+R=4R, \gamma=\frac{4}{3}=1,33.\)
მრავალი აირის ექსპერიმენტულად განსაზღვრული სითბოტევადობები ჩვეულებრივ პირობებში კარგ თანხმობეშია მოყვანილ გამოსახულებებთან. მაგრამ, მთლიანობაში სითბოტევადობის კლასიკური თეორია არ შეიძლება ჩაითვალოს ბოლომდე დამაკმაყოფილებლად. არსებობს თეორიისა და ექსპერიმენტს შორის განსხვავების მრავალი მაგალითი. ეს იმით აიხსნება, რომ კლასიკურ თეორიას არ შეუძლია სრულად გაითვალისწინოს მოლეკულებში შინაგანი მოძრაობასთან დაკავშირებული ენერგიები.
თავისუფლების ხარისხების მიხედვით ენერგიის თანაბრად განაწილების თეორია შეიძლება გამოვიყენოთ მყარ სხეულებში ნაწილაკების სითბური მოძრაობისას. კრისტალური მესერის შემადგენლობაში შემავალი ატომები წონასწორონის მდგომარეობის მახლობლად ირხევიან. ამ რხევების ენერგია მყარი სხეულის შინაგან ენერგიას წარმოადგენს. კრისტალურ მესერში ყოველ ატომს რხევა სამ ურთიერთმარობული მიმართილებით შეუძლია. ე.ი. ყოველ ატპმს თავისუფლების სამი ხარისხი აქვს. ჰარმონიული რხევების შემთხვევაში საშუალო კინეტიკური ენერგია საშუალო პოტენცური ენერგიის ტოლია. ამიტომ თავისუფლების ხარისხების მიხედვით ენერგიის თანაბრად განაწილების თეორიის შესაბამისად ყოველ რხევით ხარისხზე მოდის საშუალო \(kT\)-ტოლი კინეტიკური ენერგია, ხოლო ერთ ატომზე -\(3kT\). 1 მოლი მყარი ნივთიერების შინაგანი ენერგია ტოლია:
\(U=3N_{A}kT=3RT\)
მყარ მდგომარობაში მყოფი ნივთიერების მოლური სითბოტევადიბა ტოლია:
C = 3R = 25,12 ჯ/მოლი კ.
ამ თანაფარდობას დიულონგ-პტის კანონს უწოდებენ. მყარი სხეულებისათვის პრაქტიკულად არ არსებიბს განსხვავება Cp და CV შორის გაფართოების ან შეკუმშვის დროს შესრულებული მუშაობის უმნიშვნელოდ სიმცირის გამო.
ცდები უჩვენებენ, რონ მრავალი მყარი სხეულის (ქიმიუტი ელემენტის) მოლური სითბოტევადობა ჩვეულებრივი ტემპერატურების დროა მართლაც ტოლია 3R-ს. მაგრამ, დაბალი ტემპერატურებისას განსხვავება თეორიასა და ექსპერიმენტს შორის მნიშვნელოვანია. ეს უჩვენებს, რომ თავისუფლების ხარისხების მიხედვით ენერგიის თანაბრად განაწილების ჰიპოთეზა მიახლოებითია. სითბოტევადიბისა და ტემპერატურის ცდით დაკვირვებული დამოკიდებულება შეიძლება მხოლოდ კვანტური წარმოდგენებით აიხსნას.
{loadnavigation}
ნახ. 1-ზე პირობითადაა გამოსახული ენერგეტიკული ნაკადები განმხოლოებულ თერმოდინამიკურ სისტემასა და გარემოს შორის.
სიდიდე Q > 0, თუ სითბური ნაკადი მიმართულია თერმოდინამიკური სისტემისაკენ.
სიდიდე A > 0, თუ სისტემა გარშემომყოფ სხეულებზე ასრულებს დადებით მუშაობას.
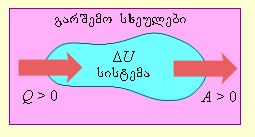
ნახ. 1. სითბის გაცვლისა და მუშაობის შესრულების შედაგად ენერგიის გაცვლა თერმოდინამიკურ სისტემასა და გარშემომყოფ სხეულებს შორის
თუ სისტემა სითბოს ცვლის გარშემომყოფ სხეულებთან და ასრულებს (დადებით ან უარყოფით) მუშაობას, მაშინ სისტემის მდგომარეობა იცვლება, ე.ი. იცველბა მისი მაკროსკოპული პარამეტრები (ტემპერატურა, წნევა, მოცულობა). რადგანაც შინაგანი ენერგია U ერთმნიშვნელოვნად სისტემის მდგომარეობის დამახასიათებელი მაკროსკოპული პარამეტრებით განისაზღვრება, ამიტომ თბოგადაცემის და მუშაობის შესრულების პროცესებს თან ახლავს შინაგანი ენერგიის ΔU ცვლილება.
თერმოდინამიკის პირველი კანონი წარმოადგენს ენერგიისა შენახვისა და გარდაქმნის კანონის განზოგადოებას თერმოდინამიკურ სისტემებზე. ის შემდეგნაირადაა ჩამოყალიბებული:
არაიზოლირებული თერმოდინამიკური სისტემის შინაგანი ენერგიის ΔU ცვლილება სისტემაზე გადაცემული სითბოს Q რაოდენობასა და სისტემის მიერ გარშემომყოფ სხეულებზე შესრულებილი A მუშაობას შორის სხვაობის ტოლია.
\(\Delta U=Q-U.\)
თერმოდინამიკის პირველი კანონის გამომსახველ ფორმულას ხშირად სხვა სახით წერენ:
\(Q=\Delta U+A\)
სისტემის მიერ მიღებული სითბოს რაოდენობა იხარჯება მისი შინაგანი ენერგიის ცვლილებასა და მის მიერ გარშემომყოფ სხეულებზე A მუშაობის შესრულებაზე.
თერმოდინამიკის პირველი კანონი დაკვირვებითი ფაქტების განზოგადოებას წარმოადგენს. ამ კანონის თანახმად, ენერგიის შექმნა ან განადგურება შეუძლებელია: ის ერთი სისტემიდან მეორეს გადაეცემა და გარდაიქმნება ერთი სახის ენერგიიდან მეორე სახისად. თერმოდინამიკის პირველი კანონის მნიშვნელოვან შედეგს წაემოადგეს მტკიცება ისეთი მანქანის შექმნის შეუძლებლობის შესახემ, რომელიც სასარგებლო მუშაობას გარედან ენერგიის მოხმარების გარეშე შეასრულებს. ასეთ ჰიპოტეტურ მანქანას პირველი გვარის მუდმივი ძრავი (perpetuum mobile) ეწოდება. ასეთი მანქანის მრავალრიცხოვანი მცდელობა ყოველთვის წარუმატებელად მთავრდებოდა. ნებისმიერ მანქანას გარშემომყოფ სხეულებზე დადებითი A მუშაობის შესრულება შეუძლია მხოლოდ გარკვეული Q სითბოს რაოდენობის მიღებით გარშემომყოფი სხეულებიდან ან საკუთარი შინაგანი ენერგიის ΔU-ით შემცირებით.
თერმოდინამიკის პირველი კანონი გამოვიყენოთ აირების იზოპროცესებში.
- იზოქოrულ პროცესში (V = const) აირი მუშაობას არ ასრულებს, A = 0. შესაბამისად,
\(Q=\Delta U=U(T_{2})-U(T_{1}).\)
აქ U (T1) და U (T2) აირის შინაგანი ენერგიაა საწყის და საბოლოო მდგომარეობებში. იდეალური აირის შiნაგანი ენერგია ტემპერატურაზეა დამოკიდებული (ჯოულის კანონი). იზოქორული გათბობისას სითბო შთაინთქმება აირის მიერ (Q > 0), და მისი შინაგანი ენერგია იზრდება. გაციებისას სითბო გარშემო სხეულებს გადაეცემა (Q < 0).
- იზობარულ პროცესში (p = const) აირის მიერ შესრულებული მუშაობა გამოისახება ფორმულით
\(A=p(V_{2}-V_{1})=p\Delta V.\)
თერმოდინამიკის პირველი კანონი იზობარული პროცესისათვის გამოისახება ფორმულით:
\(Q=U(T_{2})-U(T_{1})+p(V_{2}-V_{1})=\Delta U +p\Delta V.\)
იზობარული გაფართოებისას Q > 0 - სითბო აირის მიერ შთაინთქმება და აირი ასრულებს დადებით მუშაობას. იზობარული შეკუმშვისას Q < 0 - სითბო გარშემო სხეულებს გადაეცემა. ამ შემთხვევაში A < 0. აირის ტემპერატურა იზობარული შეკუმშვისას მცირდება, T2 < T1; შიმაგანი ენერგია კლებულობს, ΔU < 0.
- იზოთერმულ პროცესში აირის ტემპერატურა არ იცვლება, ე.ი., არ იცვლება აირის შინაგანი ენერგიაც, ΔU = 0.
თერმოდინამიკის პირველი კანონი იზოთერმული პროცესისათვის გამოისახება ფორმულით:
\(Q=A.\)
იზოთერმული გაფართოებისას აირის მიერ მიღებული სითბოს რაოდენობა გარდაიქმნება გარშემომყოფ სხეულებზე მუშაობაში. იზოთერმული შეკუმშვისას გარე ძალების აირზე შესრულებული მუშაობა გარდაიქმნება სითბოდ, რომელიც გარშემომყოფ სხეულებს გადაეცემა.
იზოქორული, იზობარული და იზოთერმული პროცესების გარდა თერმოდინამიკაში განიხილება პროცესები, რომლებიც გარშემომყოფ სხეულებთან თბოგადაცემის გარეშე მიმდინარეობს. ჭურჭელს სითბოგაუმტარი კედლებით ადიაბატური გარსი ეწოდება, ხოლო აირის გაფართოების ან შეკუმშვის პროცესს ასეთ ჭურჭელში ადიაბატური პროცესი.
ადიაბატურ პროცესში Q = 0; ამიტომ თერმოდინამიკის პირველი კანონს აქვს სახე
\(A=-\Delta U,\)
ე.ი. აირი მუშაობას საკუთარი შინაგანი ენერგიის შემცირების ხარჯზე ასრულებს.
(p, V) სიბრტყეზე აირის ადიაბატური გაფართოების (ან შეკუმშვის) პროცესი გამოსახულია მრუდით, რომელსაც ადიაბატა ეწოდება. ადიაბატური გაფართოებისას აირი ასრულებს დადებით მუშაობას (A > 0); ამიტომ მისი შინაგანი ენერგია მცირდება (ΔU < 0). ამას აირის ტემპერატურის შემცირებამდე მივყევართ. ამის შედეგად აირის წნევა ადიაბატური გაფართოებისას უფრო სწრაფად კლებულობს ვიდრე იზოთერმულისას (ნახ. 2).
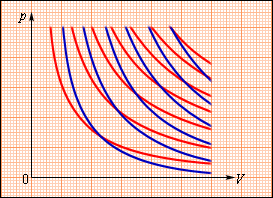
ნახ. 2.
იდეალური აირის იზოთერმები (წითელი მრუდები) და ადიაბატები (ლურჯი მრუდები)
იდეალური აირის ადიაბატური პროცესისთვის თერმოდინამიკაში გამოყვანილია განტოლება. (p, V) კოორდინატებში მას აქვს სახე
pVγ = const.
ამ განტოლებას პუასონის განტოლებას უწოდებენ. აქ γ = Cp / CV - ადიაბატის მაჩვენებელია, Cp და CV – მუდმივი წნევისა და მუდმივი ტემპერატურის პროცესებში აირის სითბოტევადობებია. ერთატომიანი აირისათვის \(\gamma=\frac{5}{3}=1,67;\)ორატომიანისატვის \(\gamma=\frac{7}{5}=1,4;\) მრავალატომიანისათვის \(\gamma=1,33.\) აირის მუშაობა ადიაბატურ პროცესებში გამოისახება უბრალოდ საწყისი და საბოლოო მდგომარეობის ტემპერატურების საშუალებით:
\(A=C_{V}(T_{2}-T_{1}).\)
ადიაბატური პროცესები შეიძლება იზოპროცესებსაც მივაკუთნოთ. თერმოდინამიკაში მნიშვნელოვან როლს ასრულებს სიდიდე, რომელსაც ენტროპიას უწოდებენ. ენტროპიის ცვლილება რაიმე კვაზისტატისტიკურ პროცესში ტოლია სისტემის მიერ მიღებული სითბოსი ΔQ / T. რადგანაც ადიაბატური პროცესის ნებისმიერ მონაკვეთზე ΔQ = 0, ენტროპა ამ პროცესში უცვლელი რჩება.
ადიაბატური პროცესი (ისევე, როგორც სხვა იზოპროცესები) კვაზისტატისტიკურ პროცესს წარმოადგენს. ამ პროცესში აირის ყოველი შუალედური მდგომარეობა თერმოდინამიკურ წონასწორობასთან ახლოსაა. ადიაბატის ყოvელი წერtილი წონასწორულ მდგომარეობას აღწერს.
ადიაბატურ გარსში მიმდინარე, ე.ი. გარშემომყოფ სხეულებთან თბოგაცვლის გარეშე მიმდინარე ყოველი პროცესი არ აკმაყოფილებს ამ პირობას. ისეთი კვაზისტატისტიკური პროცესის მაგალითს, სადაც შუალედური მდგომარეობები წონასწორული არ არის, შეიძლება წარმოადგენდეს სიცარიელეში აირის გაფართოება. ნახაზზე 3 გამოსახულია K ონკანით გაყოფილი, ორი ჭურჭლისაგან შემდგარი, ხისტი ადიაბატური გარსი. საწყის მდგომარეობაში აირი ერთერთ ჭურჭელს ავსებს, მეორეში კი ვაკუუმია. ონკანის გახსნის მერე აირი ავსებს ორივე ჭურჭელს და მყარდება ახალი წონასწორული მდგომარეობა. ამ პროცესში Q = 0, რადგანაც გარშემომყოფ სხეილებთან თბოგაცვლას არ აქვს ადგილი და A = 0, ე.წ. გარსი დეფორმაციას არ განიცდის. თერმოდინამიკის პირველი კანონიდან გამოდის: ΔU = 0, ე.ი. აირის შინაგანი ენერგია უცვლელი რჩება. რადგანაც იდეალური აირის შინაგანი ენერგია მხოლოდ ტემპერატურაზეა დამოკიდებული, აირის ტემპერატურა საწყის და საბოლოო მდგომარეოებში ერთნაირია - ამ მდგომარეობების გამომსახველი წერტილები (p, V) სიბრტყეზე ერთ იზოთერმზე მდებარეობენ. აირის არცერთი შუალედური მდგომარეობა წონასწორული არ არის და მათი დიაგრამაზე გამოსახვა არ შეიძლება.
აირის სიცარიელეში გაფართოება - შეუქცევადი პროცესის მაგალითია. მისი შებრუნებული მიმართილებით შესრულება შეუძლებელია.
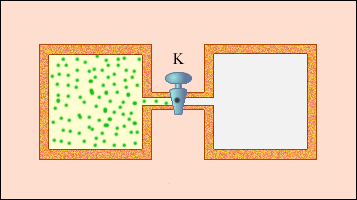
ნახ. 3.9.3.
აირის გაფართოება სიცარიელეში
{loadnavigation}
თერმოდინამიკა- მეცნიერებაა, რომელიც სითბურ მოვლენებს სწავლობს. მოლეკულურ-კინეტიკური თეორიისგან განსხვავებით, რომელიც ნივთიერების მოლეკულურ აგებულებაზე დაყრდნობით აკეთებს დასკვნებს, თერმოდინამიკა სითბური პროცესებისა და მაკროსკოპული სისტემების თვისებების რაც შეიძლება ზოგად კანონზომიერებებს შეისწავლის. თერმოდინამიკის დასკვნები დაკვირვებითი ფაქტების ერთობლიობას ეყრდნობა და არაა დამოკიდებული ნივთიერების შინაგანი აგებულების შესახებ ჩვენს ცოდნაზე, თუმცა ბევრ შემთხვევაში თერმოდინამიკა მოლეკულურ-კინეტიკური თეორიის მოდელებს იყენებს თავისი დასკვნების ილუსტრირებისათვის.
თერმოდინამიკა განიხილავს თერმოდინამიკურ წონასწორობაში მყოფ სხეულთა იზოლერებულ სისტემას. ეს ნიშნავს, რომ ასეთ სისტემებში შეწყდა ყოველგვარი მაკროსკოპული პროცესი. თერმოდინამიკურ წონასწორობაში მყოფი სისტემის მნიშვნელოვან თვისება მის ყოველ ნაწილში ტემპერატურის გათანაბრებაა.
თუ თერმოდინამიკურმა სისტემამ განიცადა გარეგანი ზემოქმედება, საბოლოოდ ის სხვა წონასწორულ მდგომარეობაში გადავა. ასეთ გადასვლას თერმოდინამიკურ პროცესს უწოდებენ. თუ პროცესი საკმარისად ნელა მიმდინარეობს (ზღვარში უსასრულოდ ნელა), მაშინ სისტემა დროის ყოველ მომენტში წონასწორულ მდომარეობასთან ახლოს იმყოფება. პროცესებს, რომლებიც წონასწორული მდგომარეობების მიმდევრობისაგან შედგებიან, კვაზიპროცესებს უწოდებენ.
თერმოდინამიკის ერთ-ერთ უმნიშვნელოვანეს ცნებას სხეულის შინაგანი ენერგია წარმოადგენს. ყველა მაკროსკოპულ სხეულს აქვს ენერგია, რომელიც შიგ სხეულშია მოქცეული. მოლეკულურ-კინეტიკური თეორიის თვალსაზრისით ნივთიერების შინაგანი ენერგია იქმნება ყველა ატომის და მოლეკულის კინეტიკური ენერგიისა და მათი ურთიერთქმედების პოტენციური ენერგიების ჯამისაგან. კერძოდ, იდეალური აირის შინაგანი ენერგია ტოლია უწყვეტ და ქაუსურ სითბურ მოძრაობაში მყოფი ყველა ნაწილაკის კინეტიკური ენერგიების ჯამისა. აქედან გამომდინარეობს მრავალი ექსპერიმენტით დამტკიცებული ჯოულის კანონი:
იდეალური აირის შინაგანი ენერგია დამოკიდებულია მხოლოდ მის ტემპერატურაზე, და არაა დამოკიდებული მოცულობაზე.
მოლეკულურ-კინეტიკურ თეორიას ერთი მოლი ერთატომიანი (ჰელიუმი, ნეონი და სხვა) იდეალური აირისთვის, რომელიც მხოლოს გადატანით მოძრაობას ასრულებს, შინაგანი ენერგიის შემდეგ გამოსახულებასთან მივყავართ:
\(U=\frac{3}{2}N_{A}kT=\frac{3}{2}RT.\)
რადგანაც, მოლეკულების ურთიერთქმედების პოტენციური ენერგია მათ შორის მანძილზეა დამოკიდებული, ზოგადად სხეულის შინაგანი \(U\) ენერგია \(T\) ტემპერატურის გარდა \(V\) მოცულობაზეა დამოკიდებული.
\(U=U(T,V).\)
ამგვარად, სხეულის შინაგანი ენერგია ერთნმიშვნელოვნად განისაზღვრება სხეულის მდგომარეობის მახასიათებელი მაკროსკოპული პარამეტრებით. ის არაა დამოკიდებული იმაზე თუ რა გზით მოხდა ამ მდგომარეობის რეალიზაცია. მიღებულია გამოთქმა: შინაგანი ენერგია მდგომარეობის ფუნქციაა.
სხეულის შინაგანი ენერგია შეიძლება შეიცვალოს, თუ მასზე მომქმედი გარე ძალები ასრულებენ მუშაობას (დადებითს ან უარყოფითს). მაგალითად, თუ აირი ცილინდრში დგუშის ქვეშ იკუმშება, გარე ძალები აირზე ასრულებეს გარკვეულ დადებით მუშაობას \(A^{`}\). ამავე დროს აირის მხრიდან დგუშზე მომქმედი წნევის ძალები ასრულებენ \(A=-A^{`}\) მუშაობას. თუ აირის მოცულობა შეიცვალა მცირე \(\Delta V\) სიდიდით, აირი ასრულებს \(pS\Delta x=p\Delta V\) მუშაობას, სადაც \(p\) – აირის წნევა, \(S\) - დგუშის ფართობი, \(\Delta x\) - მისი გადაადგილებაა (ნახ. 1.). გაფართოებისას აირი ასრულებს დადებით მუშაობას, შეკუმშვისას – უარყოფითს. ზოგად შემთხვევაში გარკვეული საწყისი მდგომარეობიდან (1) საბოლოო (2) მდგომარეობაში გადასვლისას აირის მიერ შესრულებული მუშაობა გამოისახება ფორმულით:
\(A=\sum p_{i}\Delta V_{i},\)
ან როცა \(\Delta V_{i} \to 0\):
\(A=\int_{V_{i}}^{V_{2}}pdV.\)
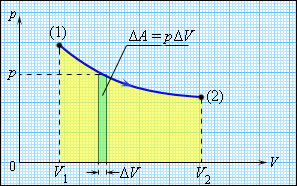
ნახ. 1.
აირის მუშაობა გაფართოებისას
მუშაობა რიცხობრივად (p, V) დიაგრამაზე პროცესის გრაფიკის ქვეშა ფართობის ტოლია. მუშაობის სიდიდე დამოკიდებულია იმაზე, თუ რა გზით მოხდა გადასვლა საწყისი მდგომარეობიდან საბოლოოზე. ნახ. 2. (1)-დან (2)–ზე გადასვლის სამი განსხვავებული პროცესია გამოსახული. სამივე შემთხვევაში სხვადასხვა მუშაობა სრულდება.
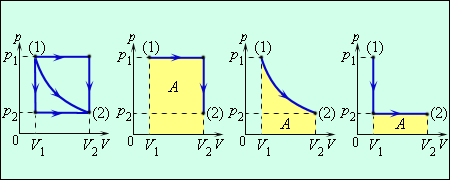
ნახ. 2.(1)-დან (2) მდგომარეობაში გადასვლის სამი სხვადასხვა გზა. თითოეულ შემთხვევაში აირი განსხვავებულ მუშაობას ასრულებს, რომელიც პროცესის ქვეშა ფართობის ტოლია.
ნახ. 2 გამოსახული პროცესები შეიძლება საწინააღმდეგო მიმდევრობითაც მიმდინარეობდეს; მაშინ მუშაობა A უბრალოდ იღებს საწინააღმდეგო ნიშანს. ამგვარ პროცესებს, რომლებიც შეიძლება ორივე მიმართულებით მიმდინარეობდეს შექცევადს უწოდებენ.
აირებისაგან განსხვავებით, სითხეებსა და მყარ სხეულებში მოცულობა მცირედ იცვლება, ასე რომ ბევრ შემთხვევაში გაფართოება ან შეკუმშვა შეიძლება უგულვებელვყოთ. მიუხედავად ამისა მუშაობის შედეგად სითხეებისა და მყარი სხეულების შინაგანი ენერგიაც იცვლება. დეტალები მექანიკური დამუშავებისას (მაგალითად ბურღვისას) თბებიან. ეს ნიშნავს, რომ მათი შინაგანი ენერგია იცვლება. სხვა მაგალითად შეიძლება გამოდგეს სითბოს მექანიკური ექვივალენტის განსაზღვრის (ნახ. 3) ჯოულისეული ცდა (1843 წ.). სითხეში ჩაძირული ციბრუტის ბრუნვისას გარე ძალები დადებით მუშაობას ასრულებენ (A` > 0); ამ დროს სითხე შინაგანი ხახუნის ძალების მოქმედებით თბება, ე.ი. იზრდება მისი შინაგანი ენერგია. მაგალითად მოყვანილ ორივე შემთხვევაში პროცესი არ შეიძლება წარვმართოდ საწინააღმდეგო მიმართულებით. ასეთ პოცესემს შეუქცევადი ეწოდება,

ნახ. 3.8.3.
სითბოს მექანიკური ექვივალენტის განსაზღვრის (ნახ. 3) ჯოულისეული ცდა, გამარტივებული სქემა.
სხეულის შინაგანი ენერგია შეიძლება შეიცვალოს არა მხოლოდ მუშაობის შესრულებით, არამედ თბოგაცვლითაც. სხეულების სითბური კონტაქტის შემთხვევაში ერთი სხეულის შინაგანი ენერგია იზრდება, მეორისა კი კლებულობს. ამ შემთხვევაში ლაპარაკობენ ერთი სხეულიდან მეორეზე გადასულ სითბურ ნაკადზე. სხეულის მიერ მიღებული სითბოს რაოდენობას თბოგაცვლის შედეგად სხეულის შინაგანი ენერგიის ცვლილებას უწოდებენ.
სითბოს სახით ენერგიის გადაცემა ერთი სხეულიდან მეორეზე შესაძლებელია ტემპერატურული სხვაობის არსებობის შემთხვევაში.
სითბური ნაკადი ყოველთვის ცხელი ხსეულიდან ცივისაკენაა მიმართული.
სითბოს რაოდენობა ენერგეტიკულ სიდიდეს წარმოადგენს. სი სისტემაში სითბოს რაოდენობა იზომება მექანიკური მუშაობის ერთეულებში – ჯოულებში.
