ნახ. 1-ზე პირობითადაა გამოსახული ენერგეტიკული ნაკადები განმხოლოებულ თერმოდინამიკურ სისტემასა და გარემოს შორის.
სიდიდე Q > 0, თუ სითბური ნაკადი მიმართულია თერმოდინამიკური სისტემისაკენ.
სიდიდე A > 0, თუ სისტემა გარშემომყოფ სხეულებზე ასრულებს დადებით მუშაობას.
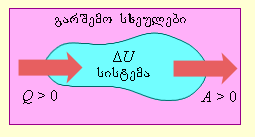
ნახ. 1. სითბის გაცვლისა და მუშაობის შესრულების შედაგად ენერგიის გაცვლა თერმოდინამიკურ სისტემასა და გარშემომყოფ სხეულებს შორის
თუ სისტემა სითბოს ცვლის გარშემომყოფ სხეულებთან და ასრულებს (დადებით ან უარყოფით) მუშაობას, მაშინ სისტემის მდგომარეობა იცვლება, ე.ი. იცველბა მისი მაკროსკოპული პარამეტრები (ტემპერატურა, წნევა, მოცულობა). რადგანაც შინაგანი ენერგია U ერთმნიშვნელოვნად სისტემის მდგომარეობის დამახასიათებელი მაკროსკოპული პარამეტრებით განისაზღვრება, ამიტომ თბოგადაცემის და მუშაობის შესრულების პროცესებს თან ახლავს შინაგანი ენერგიის ΔU ცვლილება.
თერმოდინამიკის პირველი კანონი წარმოადგენს ენერგიისა შენახვისა და გარდაქმნის კანონის განზოგადოებას თერმოდინამიკურ სისტემებზე. ის შემდეგნაირადაა ჩამოყალიბებული:
არაიზოლირებული თერმოდინამიკური სისტემის შინაგანი ენერგიის ΔU ცვლილება სისტემაზე გადაცემული სითბოს Q რაოდენობასა და სისტემის მიერ გარშემომყოფ სხეულებზე შესრულებილი A მუშაობას შორის სხვაობის ტოლია.
\(\Delta U=Q-U.\)
თერმოდინამიკის პირველი კანონის გამომსახველ ფორმულას ხშირად სხვა სახით წერენ:
\(Q=\Delta U+A\)
სისტემის მიერ მიღებული სითბოს რაოდენობა იხარჯება მისი შინაგანი ენერგიის ცვლილებასა და მის მიერ გარშემომყოფ სხეულებზე A მუშაობის შესრულებაზე.
თერმოდინამიკის პირველი კანონი დაკვირვებითი ფაქტების განზოგადოებას წარმოადგენს. ამ კანონის თანახმად, ენერგიის შექმნა ან განადგურება შეუძლებელია: ის ერთი სისტემიდან მეორეს გადაეცემა და გარდაიქმნება ერთი სახის ენერგიიდან მეორე სახისად. თერმოდინამიკის პირველი კანონის მნიშვნელოვან შედეგს წაემოადგეს მტკიცება ისეთი მანქანის შექმნის შეუძლებლობის შესახემ, რომელიც სასარგებლო მუშაობას გარედან ენერგიის მოხმარების გარეშე შეასრულებს. ასეთ ჰიპოტეტურ მანქანას პირველი გვარის მუდმივი ძრავი (perpetuum mobile) ეწოდება. ასეთი მანქანის მრავალრიცხოვანი მცდელობა ყოველთვის წარუმატებელად მთავრდებოდა. ნებისმიერ მანქანას გარშემომყოფ სხეულებზე დადებითი A მუშაობის შესრულება შეუძლია მხოლოდ გარკვეული Q სითბოს რაოდენობის მიღებით გარშემომყოფი სხეულებიდან ან საკუთარი შინაგანი ენერგიის ΔU-ით შემცირებით.
თერმოდინამიკის პირველი კანონი გამოვიყენოთ აირების იზოპროცესებში.
- იზოქოrულ პროცესში (V = const) აირი მუშაობას არ ასრულებს, A = 0. შესაბამისად,
\(Q=\Delta U=U(T_{2})-U(T_{1}).\)
აქ U (T1) და U (T2) აირის შინაგანი ენერგიაა საწყის და საბოლოო მდგომარეობებში. იდეალური აირის შiნაგანი ენერგია ტემპერატურაზეა დამოკიდებული (ჯოულის კანონი). იზოქორული გათბობისას სითბო შთაინთქმება აირის მიერ (Q > 0), და მისი შინაგანი ენერგია იზრდება. გაციებისას სითბო გარშემო სხეულებს გადაეცემა (Q < 0).
- იზობარულ პროცესში (p = const) აირის მიერ შესრულებული მუშაობა გამოისახება ფორმულით
\(A=p(V_{2}-V_{1})=p\Delta V.\)
თერმოდინამიკის პირველი კანონი იზობარული პროცესისათვის გამოისახება ფორმულით:
\(Q=U(T_{2})-U(T_{1})+p(V_{2}-V_{1})=\Delta U +p\Delta V.\)
იზობარული გაფართოებისას Q > 0 - სითბო აირის მიერ შთაინთქმება და აირი ასრულებს დადებით მუშაობას. იზობარული შეკუმშვისას Q < 0 - სითბო გარშემო სხეულებს გადაეცემა. ამ შემთხვევაში A < 0. აირის ტემპერატურა იზობარული შეკუმშვისას მცირდება, T2 < T1; შიმაგანი ენერგია კლებულობს, ΔU < 0.
- იზოთერმულ პროცესში აირის ტემპერატურა არ იცვლება, ე.ი., არ იცვლება აირის შინაგანი ენერგიაც, ΔU = 0.
თერმოდინამიკის პირველი კანონი იზოთერმული პროცესისათვის გამოისახება ფორმულით:
\(Q=A.\)
იზოთერმული გაფართოებისას აირის მიერ მიღებული სითბოს რაოდენობა გარდაიქმნება გარშემომყოფ სხეულებზე მუშაობაში. იზოთერმული შეკუმშვისას გარე ძალების აირზე შესრულებული მუშაობა გარდაიქმნება სითბოდ, რომელიც გარშემომყოფ სხეულებს გადაეცემა.
იზოქორული, იზობარული და იზოთერმული პროცესების გარდა თერმოდინამიკაში განიხილება პროცესები, რომლებიც გარშემომყოფ სხეულებთან თბოგადაცემის გარეშე მიმდინარეობს. ჭურჭელს სითბოგაუმტარი კედლებით ადიაბატური გარსი ეწოდება, ხოლო აირის გაფართოების ან შეკუმშვის პროცესს ასეთ ჭურჭელში ადიაბატური პროცესი.
ადიაბატურ პროცესში Q = 0; ამიტომ თერმოდინამიკის პირველი კანონს აქვს სახე
\(A=-\Delta U,\)
ე.ი. აირი მუშაობას საკუთარი შინაგანი ენერგიის შემცირების ხარჯზე ასრულებს.
(p, V) სიბრტყეზე აირის ადიაბატური გაფართოების (ან შეკუმშვის) პროცესი გამოსახულია მრუდით, რომელსაც ადიაბატა ეწოდება. ადიაბატური გაფართოებისას აირი ასრულებს დადებით მუშაობას (A > 0); ამიტომ მისი შინაგანი ენერგია მცირდება (ΔU < 0). ამას აირის ტემპერატურის შემცირებამდე მივყევართ. ამის შედეგად აირის წნევა ადიაბატური გაფართოებისას უფრო სწრაფად კლებულობს ვიდრე იზოთერმულისას (ნახ. 2).
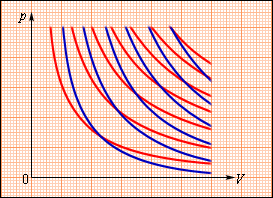
ნახ. 2.
იდეალური აირის იზოთერმები (წითელი მრუდები) და ადიაბატები (ლურჯი მრუდები)
იდეალური აირის ადიაბატური პროცესისთვის თერმოდინამიკაში გამოყვანილია განტოლება. (p, V) კოორდინატებში მას აქვს სახე
pVγ = const.
ამ განტოლებას პუასონის განტოლებას უწოდებენ. აქ γ = Cp / CV - ადიაბატის მაჩვენებელია, Cp და CV – მუდმივი წნევისა და მუდმივი ტემპერატურის პროცესებში აირის სითბოტევადობებია. ერთატომიანი აირისათვის \(\gamma=\frac{5}{3}=1,67;\)ორატომიანისატვის \(\gamma=\frac{7}{5}=1,4;\) მრავალატომიანისათვის \(\gamma=1,33.\) აირის მუშაობა ადიაბატურ პროცესებში გამოისახება უბრალოდ საწყისი და საბოლოო მდგომარეობის ტემპერატურების საშუალებით:
\(A=C_{V}(T_{2}-T_{1}).\)
ადიაბატური პროცესები შეიძლება იზოპროცესებსაც მივაკუთნოთ. თერმოდინამიკაში მნიშვნელოვან როლს ასრულებს სიდიდე, რომელსაც ენტროპიას უწოდებენ. ენტროპიის ცვლილება რაიმე კვაზისტატისტიკურ პროცესში ტოლია სისტემის მიერ მიღებული სითბოსი ΔQ / T. რადგანაც ადიაბატური პროცესის ნებისმიერ მონაკვეთზე ΔQ = 0, ენტროპა ამ პროცესში უცვლელი რჩება.
ადიაბატური პროცესი (ისევე, როგორც სხვა იზოპროცესები) კვაზისტატისტიკურ პროცესს წარმოადგენს. ამ პროცესში აირის ყოველი შუალედური მდგომარეობა თერმოდინამიკურ წონასწორობასთან ახლოსაა. ადიაბატის ყოvელი წერtილი წონასწორულ მდგომარეობას აღწერს.
ადიაბატურ გარსში მიმდინარე, ე.ი. გარშემომყოფ სხეულებთან თბოგაცვლის გარეშე მიმდინარე ყოველი პროცესი არ აკმაყოფილებს ამ პირობას. ისეთი კვაზისტატისტიკური პროცესის მაგალითს, სადაც შუალედური მდგომარეობები წონასწორული არ არის, შეიძლება წარმოადგენდეს სიცარიელეში აირის გაფართოება. ნახაზზე 3 გამოსახულია K ონკანით გაყოფილი, ორი ჭურჭლისაგან შემდგარი, ხისტი ადიაბატური გარსი. საწყის მდგომარეობაში აირი ერთერთ ჭურჭელს ავსებს, მეორეში კი ვაკუუმია. ონკანის გახსნის მერე აირი ავსებს ორივე ჭურჭელს და მყარდება ახალი წონასწორული მდგომარეობა. ამ პროცესში Q = 0, რადგანაც გარშემომყოფ სხეილებთან თბოგაცვლას არ აქვს ადგილი და A = 0, ე.წ. გარსი დეფორმაციას არ განიცდის. თერმოდინამიკის პირველი კანონიდან გამოდის: ΔU = 0, ე.ი. აირის შინაგანი ენერგია უცვლელი რჩება. რადგანაც იდეალური აირის შინაგანი ენერგია მხოლოდ ტემპერატურაზეა დამოკიდებული, აირის ტემპერატურა საწყის და საბოლოო მდგომარეოებში ერთნაირია - ამ მდგომარეობების გამომსახველი წერტილები (p, V) სიბრტყეზე ერთ იზოთერმზე მდებარეობენ. აირის არცერთი შუალედური მდგომარეობა წონასწორული არ არის და მათი დიაგრამაზე გამოსახვა არ შეიძლება.
აირის სიცარიელეში გაფართოება - შეუქცევადი პროცესის მაგალითია. მისი შებრუნებული მიმართილებით შესრულება შეუძლებელია.
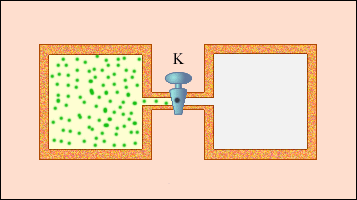
ნახ. 3.9.3.
აირის გაფართოება სიცარიელეში


