თერმოდინამიკა- მეცნიერებაა, რომელიც სითბურ მოვლენებს სწავლობს. მოლეკულურ-კინეტიკური თეორიისგან განსხვავებით, რომელიც ნივთიერების მოლეკულურ აგებულებაზე დაყრდნობით აკეთებს დასკვნებს, თერმოდინამიკა სითბური პროცესებისა და მაკროსკოპული სისტემების თვისებების რაც შეიძლება ზოგად კანონზომიერებებს შეისწავლის. თერმოდინამიკის დასკვნები დაკვირვებითი ფაქტების ერთობლიობას ეყრდნობა და არაა დამოკიდებული ნივთიერების შინაგანი აგებულების შესახებ ჩვენს ცოდნაზე, თუმცა ბევრ შემთხვევაში თერმოდინამიკა მოლეკულურ-კინეტიკური თეორიის მოდელებს იყენებს თავისი დასკვნების ილუსტრირებისათვის.
თერმოდინამიკა განიხილავს თერმოდინამიკურ წონასწორობაში მყოფ სხეულთა იზოლერებულ სისტემას. ეს ნიშნავს, რომ ასეთ სისტემებში შეწყდა ყოველგვარი მაკროსკოპული პროცესი. თერმოდინამიკურ წონასწორობაში მყოფი სისტემის მნიშვნელოვან თვისება მის ყოველ ნაწილში ტემპერატურის გათანაბრებაა.
თუ თერმოდინამიკურმა სისტემამ განიცადა გარეგანი ზემოქმედება, საბოლოოდ ის სხვა წონასწორულ მდგომარეობაში გადავა. ასეთ გადასვლას თერმოდინამიკურ პროცესს უწოდებენ. თუ პროცესი საკმარისად ნელა მიმდინარეობს (ზღვარში უსასრულოდ ნელა), მაშინ სისტემა დროის ყოველ მომენტში წონასწორულ მდომარეობასთან ახლოს იმყოფება. პროცესებს, რომლებიც წონასწორული მდგომარეობების მიმდევრობისაგან შედგებიან, კვაზიპროცესებს უწოდებენ.
თერმოდინამიკის ერთ-ერთ უმნიშვნელოვანეს ცნებას სხეულის შინაგანი ენერგია წარმოადგენს. ყველა მაკროსკოპულ სხეულს აქვს ენერგია, რომელიც შიგ სხეულშია მოქცეული. მოლეკულურ-კინეტიკური თეორიის თვალსაზრისით ნივთიერების შინაგანი ენერგია იქმნება ყველა ატომის და მოლეკულის კინეტიკური ენერგიისა და მათი ურთიერთქმედების პოტენციური ენერგიების ჯამისაგან. კერძოდ, იდეალური აირის შინაგანი ენერგია ტოლია უწყვეტ და ქაუსურ სითბურ მოძრაობაში მყოფი ყველა ნაწილაკის კინეტიკური ენერგიების ჯამისა. აქედან გამომდინარეობს მრავალი ექსპერიმენტით დამტკიცებული ჯოულის კანონი:
იდეალური აირის შინაგანი ენერგია დამოკიდებულია მხოლოდ მის ტემპერატურაზე, და არაა დამოკიდებული მოცულობაზე.
მოლეკულურ-კინეტიკურ თეორიას ერთი მოლი ერთატომიანი (ჰელიუმი, ნეონი და სხვა) იდეალური აირისთვის, რომელიც მხოლოს გადატანით მოძრაობას ასრულებს, შინაგანი ენერგიის შემდეგ გამოსახულებასთან მივყავართ:
\(U=\frac{3}{2}N_{A}kT=\frac{3}{2}RT.\)
რადგანაც, მოლეკულების ურთიერთქმედების პოტენციური ენერგია მათ შორის მანძილზეა დამოკიდებული, ზოგადად სხეულის შინაგანი \(U\) ენერგია \(T\) ტემპერატურის გარდა \(V\) მოცულობაზეა დამოკიდებული.
\(U=U(T,V).\)
ამგვარად, სხეულის შინაგანი ენერგია ერთნმიშვნელოვნად განისაზღვრება სხეულის მდგომარეობის მახასიათებელი მაკროსკოპული პარამეტრებით. ის არაა დამოკიდებული იმაზე თუ რა გზით მოხდა ამ მდგომარეობის რეალიზაცია. მიღებულია გამოთქმა: შინაგანი ენერგია მდგომარეობის ფუნქციაა.
სხეულის შინაგანი ენერგია შეიძლება შეიცვალოს, თუ მასზე მომქმედი გარე ძალები ასრულებენ მუშაობას (დადებითს ან უარყოფითს). მაგალითად, თუ აირი ცილინდრში დგუშის ქვეშ იკუმშება, გარე ძალები აირზე ასრულებეს გარკვეულ დადებით მუშაობას \(A^{`}\). ამავე დროს აირის მხრიდან დგუშზე მომქმედი წნევის ძალები ასრულებენ \(A=-A^{`}\) მუშაობას. თუ აირის მოცულობა შეიცვალა მცირე \(\Delta V\) სიდიდით, აირი ასრულებს \(pS\Delta x=p\Delta V\) მუშაობას, სადაც \(p\) – აირის წნევა, \(S\) - დგუშის ფართობი, \(\Delta x\) - მისი გადაადგილებაა (ნახ. 1.). გაფართოებისას აირი ასრულებს დადებით მუშაობას, შეკუმშვისას – უარყოფითს. ზოგად შემთხვევაში გარკვეული საწყისი მდგომარეობიდან (1) საბოლოო (2) მდგომარეობაში გადასვლისას აირის მიერ შესრულებული მუშაობა გამოისახება ფორმულით:
\(A=\sum p_{i}\Delta V_{i},\)
ან როცა \(\Delta V_{i} \to 0\):
\(A=\int_{V_{i}}^{V_{2}}pdV.\)
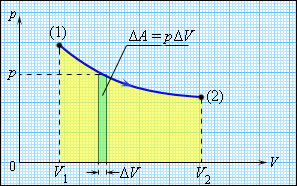
ნახ. 1.
აირის მუშაობა გაფართოებისას
მუშაობა რიცხობრივად (p, V) დიაგრამაზე პროცესის გრაფიკის ქვეშა ფართობის ტოლია. მუშაობის სიდიდე დამოკიდებულია იმაზე, თუ რა გზით მოხდა გადასვლა საწყისი მდგომარეობიდან საბოლოოზე. ნახ. 2. (1)-დან (2)–ზე გადასვლის სამი განსხვავებული პროცესია გამოსახული. სამივე შემთხვევაში სხვადასხვა მუშაობა სრულდება.
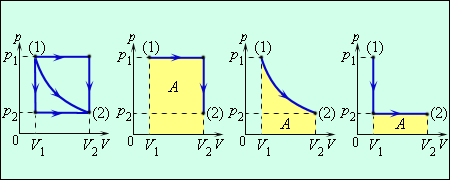
ნახ. 2.(1)-დან (2) მდგომარეობაში გადასვლის სამი სხვადასხვა გზა. თითოეულ შემთხვევაში აირი განსხვავებულ მუშაობას ასრულებს, რომელიც პროცესის ქვეშა ფართობის ტოლია.
ნახ. 2 გამოსახული პროცესები შეიძლება საწინააღმდეგო მიმდევრობითაც მიმდინარეობდეს; მაშინ მუშაობა A უბრალოდ იღებს საწინააღმდეგო ნიშანს. ამგვარ პროცესებს, რომლებიც შეიძლება ორივე მიმართულებით მიმდინარეობდეს შექცევადს უწოდებენ.
აირებისაგან განსხვავებით, სითხეებსა და მყარ სხეულებში მოცულობა მცირედ იცვლება, ასე რომ ბევრ შემთხვევაში გაფართოება ან შეკუმშვა შეიძლება უგულვებელვყოთ. მიუხედავად ამისა მუშაობის შედეგად სითხეებისა და მყარი სხეულების შინაგანი ენერგიაც იცვლება. დეტალები მექანიკური დამუშავებისას (მაგალითად ბურღვისას) თბებიან. ეს ნიშნავს, რომ მათი შინაგანი ენერგია იცვლება. სხვა მაგალითად შეიძლება გამოდგეს სითბოს მექანიკური ექვივალენტის განსაზღვრის (ნახ. 3) ჯოულისეული ცდა (1843 წ.). სითხეში ჩაძირული ციბრუტის ბრუნვისას გარე ძალები დადებით მუშაობას ასრულებენ (A` > 0); ამ დროს სითხე შინაგანი ხახუნის ძალების მოქმედებით თბება, ე.ი. იზრდება მისი შინაგანი ენერგია. მაგალითად მოყვანილ ორივე შემთხვევაში პროცესი არ შეიძლება წარვმართოდ საწინააღმდეგო მიმართულებით. ასეთ პოცესემს შეუქცევადი ეწოდება,

ნახ. 3.8.3.
სითბოს მექანიკური ექვივალენტის განსაზღვრის (ნახ. 3) ჯოულისეული ცდა, გამარტივებული სქემა.
სხეულის შინაგანი ენერგია შეიძლება შეიცვალოს არა მხოლოდ მუშაობის შესრულებით, არამედ თბოგაცვლითაც. სხეულების სითბური კონტაქტის შემთხვევაში ერთი სხეულის შინაგანი ენერგია იზრდება, მეორისა კი კლებულობს. ამ შემთხვევაში ლაპარაკობენ ერთი სხეულიდან მეორეზე გადასულ სითბურ ნაკადზე. სხეულის მიერ მიღებული სითბოს რაოდენობას თბოგაცვლის შედეგად სხეულის შინაგანი ენერგიის ცვლილებას უწოდებენ.
სითბოს სახით ენერგიის გადაცემა ერთი სხეულიდან მეორეზე შესაძლებელია ტემპერატურული სხვაობის არსებობის შემთხვევაში.
სითბური ნაკადი ყოველთვის ცხელი ხსეულიდან ცივისაკენაა მიმართული.
სითბოს რაოდენობა ენერგეტიკულ სიდიდეს წარმოადგენს. სი სისტემაში სითბოს რაოდენობა იზომება მექანიკური მუშაობის ერთეულებში – ჯოულებში.


