| შეკითხვა: | გამარჯობათ მაინტერესებს ეს ამოცანა: მიმდევრობით შეერთებული ორი აბაზანიდან ერთი ნიკელის ხოლო მეორე ქრომის მარილითაა სავსე. განსაზღვრეთ რომელ აბაზანაში გაივლის მეტი მუხტი.(ნიკელის ელექტრო ქიმიური ეკვივალენტია 0.30 * 10^(-6), ქრომის ელექტროქიმიური ეკვივალენტია 0.18 * 10^(-6)). და მაინტერესებს, ამ ამოცანაში მიმდევრობით არის შეერთებული და პარალელურის დროს რა იქნებოდა განსხვაავება ამოხსნაში? და კიდე ელექტროქიმიური ეკვივალენტი რა არის და გამტარობა როგორ დავაკავშირო მასთან? | მე როგორც ვიცი ელექტროქიმიური ექვივალენტი არის 1 კულონ მუხტის გავლის დროს რამდენი გრამი ნივთიერება გამოიყოფა მაგრამ გამტარობასთან ვერ დავაკავშირე. ასევე მე წინაზე დავწერე აქ შეკითხვა ორ დამუხტულ ბურთულაზე და იქ მე არ მითქვამს რომ თქვენი ამოხსნა არასწორია უბრალოდ პასუხს ვერ ვიღებდი G-ს გამო რადგან არ ვიცოდი G-ს მნიშვნელობა, თუმცა Gm1m2/r-ს არ ჩათვლით მივიღე სწორი პასუხი. |
|---|---|
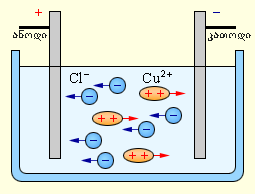
| პასუხი: | ელექტროლიტებში (გამტარ ხსნარებში) დენის გავლისას ადგილი აქვს ჟანგვა/აღდგენით ქიმიურ რეაქციებს - ელექტროდებზე ხდება ხოლმე ნივთიერების გამოყოფა და გარკვეულ დროში ამ ნივთიერების მასა მროპორციულია ამ დროში აბაზანაში გავლილ მუხტზე. დაიხმარე ჩვენი სახელმძღვანელო: ელექტროლიტებს უწოდებენ გამტარ გარემოს, რომელშიც ელექრული დენის გავლას თან ახლავს ნივთიერების გადატანა. ელექტროლიტებში თავისუფალი მუხტის მატარებლებს დადებითად და უარყოფითად დამუხტული იონები წარმოადგენენ. ელექტროლიტებს განეკუთვნებიან გამდნარ მდგომარეობაში მყოფი მარავალი მეტალის შენაერთი, და ასევე ზოგიერთი მყარი ნივთიერება. მაგრამ ელექტროლიტების ძირითად წარმომადგენლებს, რომლებსაც ფართოდ იყენებენ ტექნიკაში, არაორგანული მაჟავეების, მარილებისა და ფუძე წყალხსნარები წარმოადგენენ. ელექტროლიტში ელექტრული დენის გავლას თან ახლავს ელექტროდებზე ნივთიერების გამოყოფა. ამ მოვლენას ელექტროლიზს უწოდებენ. ელექტროლიტში ელექტრული დენი ორივე ნიშნის იონების ერთმანეთის საწინააღმდეგო მიმართულებით მოძრაობას წარმოადგენს. დადებითი იონები მოძრაობენ უარყოფითი ელექტროდისკენ (კათოდისკენ), უარყოითი იონები კი დადებითი ელექტროდისკენ (ანოდისკენ). იონები მჟავების, მარილებისა და ტუტეების წყალხსნარებში ნაწილი ნეიტრალური მოლეკულების გახლეჩვის შედეგად წარმოიქმნება. ამ მოვლენას ელექტრულ დისოციაციას უწოდებენ. მაგალითად, სპილენძის ქლორიდი, CuCl2 წყალხსნარში დისოცირდება სპილენძისა და ქლორის იონებად:
ელექტროდების დენის წყაროსთან მიერთებისას ელექტრული ველის მოქმედებით იონები იწყებენ მოწესრიგებულ მოძრაობას: სპილენძის დადებითი იონების კათოდისკენ მიემართებიან, ხოლო ქლორის უარყოფითი იონები - ანოდისაკენ (ნახ. .1). მიაღწევენ რა კათოდს სპილენძის იონები კათოდის ჭარბი ელექტრონებით ნეიტრალდებიან, ნეიტრალურ ატომებად გარდაიქმნებიან და ილექებიან კათოდზე. ქლორის იონები აღწევენ რა ანოდამდე, გასცემენ ერთ ელექტრონს. ამის შემდეგ ქლორის ნეიტრალური ატომები წყვილ-წყვილად ერთდებიან და ქმნიან ქლორის მოლეკულას Cl2. ანოდზე ქლორი ბუშტუკების სახით გამოიყოფა.
ნახ. 1. სპილენძის ქლორიდის წყალხსნარის ელექტროლიზი
ელექტროლიზის კანონი ექსპერიმენტულად დაადგინა ინგლისელმა ფიზიკოსმა მ.ფარადეიმ 1833 წელს. ფარადეის კანონი განსაზღვრავს ელექტროლიზის დროს ელექტროდებზე გამოყოფილი პირველადი პროდუქტების რაოდენობას: ელექტროდზე გამოყოფილი ნივთიერების m მასა ელექტროლიტში გატარებული Q მუხტის პირდაპირპროპორციულია: m = kQ = kIt. k სიდიდეს ელექტროქიმიურ ექვივალენტს უწოდებენ.
ასე რომ, აბაზანების მიმდევრობითი შეერთებისას(იმედია იცი რომ მიმდევრობითი შეერთებისას რაიმე დროში ყველა უბანში გავლილი მუხტი ერთიდაიგივეა- საწყის უბანში შემავალი მუხტი ტოლია ბოლო უბნიდან გამომავალი მუხტის .... დენის ძალები ყველა უბანში ტოლია) რაღაც დროში რომელ აბაზანაში მეტი ნივთიერება გამოიყოფა და რამდენჯერ?... (პასუხი თავად გაეცი) და თუ აბაზანებს პარალელურად ჩავრთავდით?... მაშინ შემავალი მუტიდან მეტი ნაწილი მცირე წინაღობიანი უბნისკენ წავიდოდა, ხომ? - q1/q2 = R2/R1 !!! და შესაბამისად m1/m2 = ???.. ყოველივე ამის შემდეგ გაძლევ ასეთ ამოცანას: დავუშვათ პარალელრი ჩართვისას ქრომის შემცველი მარილხსნარიანი აბაზანის წინაღობა 40%-ითაა ნაკლები ნიკელის შემცველი მარილხსნარიანი აბაზანის წინაღობაზე: ა) რომელ აბაზანაში მეტი მუხტი გაივლის და რამდენჯერ? ბ) რომელ აბაზანაში მეტი მასის ნივთიერება (ქრომი/ნკელი) გამოიყოფა და რამდენჯერ? |