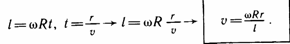| მოლეკულურ-კინეტიკური თეორიის ძირითადი დებულებები | ||
|
1. ყველა ნივთიერება შედგება უმცირესი ნაწილაკებისგან (მოლეკულენი და ატომები). მოლეკულები განცალკევებულნი არიან შუალედებით. 2. მოლეკულები უწყვეტ ქაოტურ მოძრაობას ასრულებენ. 3. მოლეკულებს შორის მოქმედებს ურთიერთქმედების ძალები (მიზიდულობა და განზიდულობა). |
||
|
ატომი - ქიმიური ელემენტის უმცირესი ნაწილია, რომელიც ატარებს მის ქიმიურ თვისებებს. ატომი შედგება დადებითად დამუხტული ბირთვისა და უარყოფიტად დამუხტული ელექტრონებისგან, რომლებიც ბირთვის კულონურ ველსი მოძრაობენ ქვანტური მექანიკის კანონების მიხედვით. ატომის ზომები რიგით 10-10 მ-ს ტოლია. |
||
|
მოლეკულა - ნივთიერების უმცირესი მდგრადი ნაწილაკი, რომელსაც აქვს ყველა ქიმიური თვისება და შედგება ერთნაირი (მარტივი ნივთიერება) ან სხვადასხვა (რთული ნივთიერება) ატომებისგან, რომლებიც ქიმიური კავშირებით ერთიანდებიან. |
||
|
მოლეკულურ-კინეტიკურური თეორიის ცდისეული დასაბუთება |
||
|
მოლეკულების არსებობა |
|
|
|
შუალედების არსებობა |
|
|
|
მოლეკულების ქაოტური მოძრაობა |
|
|
|
ურთიერთქმედების ძალები |
|
|
|
დიფუზია. ბროუნის მოძრაობა |
||
|
დიფუზია - ერთი ნივთიერების ნაწილაკების მეორე ნივტიერების ნაწილაკთა შორისებში შეღწევის მოვლენა. დიფუზიის სიჩქარე დამოკიდებულია ნივტიერების ტემპერატურასა და მდგომარეობაზე (გაზებში უფრო ჩქარია). |
||
|
ბროუნის მოძრაობა - სითხეში ან აირში შეწონილი მცირე ნაწილაკების მოუწესრიგებელი მოძრაობა, რომელიც მოლეკულების სითბური მოძრაობის გავლენით მიმდინარეობს . დააკვირდა რ. ბროუნი (1827). თეორია შექმნა - ა. აინშტაინმა (1905). პერენი (1908—1911) — ცდები. მოძრაობა არ წყდება |
||
|
როლი ბუნებასა და ტექნიკაში
|
||
|
მოლეკულურ-კინეტიკურ თეორიაში გაზების მოლეკულების სითბური მოძრაობის სიჩქარე ეფუძნება იმას, რომ გაზები შედგება უწესრიგოდ მოძრავი მოლეკულებისგან. ტემპერატურის ცნება დაკავშირებულია მოლეკულების ქაოტური მოძრაობის სიჩქარესთან შემდეგი ფორმულით \(\frac{m_{0}\bar{v^{2}}}{2}=\frac{3kT}{2}\) , სადაც - რადგან NА.k=const=R, ამიტომ \(v\)საშ=\(\sqrt{\frac{3RT}{M}}\)
როცა t0=0°С აზოტისთვის საშუალო სიჩქარეებია – 500 მ/წმ, წყალბადისთვის – 1800 მ/წმ. |
||
|
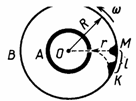
მოლეკულების მოძრაობის სიჩქარის ექსპერიმენტული განსაზღვრა შტერნის (1920წ.) ცდის არსი
|
|
|
|
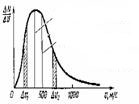
სიჩქარეების მიხედვით მოლეკულების განაწილება მოლეკულების სიჩქარეების მიხედვით განაწილების გრაფიკი. ინგლისელი ფიზიკოსი ჯ. მაქსველი და ავსტრიელი ფიზიკოსი ლ.ბოლცმანი. მაქსველი განაწილების მრუდი შეესაბამება შტერნის მიერ ცდისეულად მიღებულ შედეგებს. ნაწილაკების რაოდენობა, რომელთა სიჩქარეები მოთავსებულია ΔV1 ინტერვალში, ტოლია ΔN-ის, V - ერთ-ერთი სიჩქარეა ამ ინტერვალიდან. გრაფიკიდან ჩანს, რომ იმ ნაწილაკების რაოდენობა, რომელთა სიჩქარეები მოთავსებულია ΔV1 და Δv2 ინტერვალებში, განსხვავებულია. სიჩქარე, რომლის სიახლოვესაც განლაგებულია ყველაზე "დასახლებული" ინტერვალები არის მოლეკულების სითბური მოძრაობის ყველაზე ალბათური სიჩქარე. |
|
|
|
ძირითადი დასკვნები
|
|
|


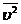 სიჩქარის კვადრატის საშუალო მნიშვნელობაა. შესაბამისად \(v\)საშ=\(\sqrt{v^{2}}=\sqrt{\frac{3kT}{m_{0}}}\)
სიჩქარის კვადრატის საშუალო მნიშვნელობაა. შესაბამისად \(v\)საშ=\(\sqrt{v^{2}}=\sqrt{\frac{3kT}{m_{0}}}\)