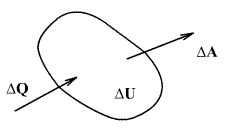
თერმოდინამიკის პირველი კანონი წარმოადგენს ენერგიის მუდმივობის კანონს. თუ სხეულს მივაწვდით ΔQ სითბოს რაოდენობას, ამ სითბოს ხარჯზე სხეულს შეუძლია გაზარდოს საკუთარი შინაგანი ენერგია ΔU სიდიდით და ამავდროულად შეასრულოს ΔA მუშაობა, ამსთან ენერგიის მუდმივობის კანონის თანახმად: ΔQ=ΔU+ΔA
უკანასკნელი გამოსახულება უფრო მოხერხებულია ჩაიწეროს სისტემაზე δQ მცირე სითბოს მიწოდებით გამოწვეული სისტემის მდგომარეობის მცირე ცვლილებისა და მის მიერ δA ელემენტური მუშაობის შესრულებისთვის
| δQ = dU+δA | (9.10) |
შინაგანი ენერგიის dU ნაზრდის ჩაწერასა და სითბოს δQ ელემენტური რაოდენობის ჩაწერასა და ასევე ელემენტური δA მუშაობის ჩაწერას შორის სხვაობა აიხსნება შემდეგი მოსაზრებით. როგორც უკვე აღვნიშნეთ, სისტემის შინაგანი ენერგია არის მისი მდგომარეობის ფუნქცია. შესაბამისად, ნებისმიერი პროცესისას, რომლის შედეგადაც სისტემა კვლავ უბრუნდება რომელიმე მდგომარეობას, მისი შინაგანი ენერგიის სრული ცვლილება ნულის ტოლია. მათემატიკურად ეს ჩაიწერება ამ განტოლების სახით 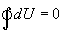
ამდენად:
δQ = dU+δA
თერმოდინამიკის პირველკი კანონი ჩამოყალიბდება ასე:
სისტემაზე გადაცემული სითბო იხარჯება სისტემის შინაგანი ენერგიის ზრდაზე და მუშაობის შესრულებაზე.