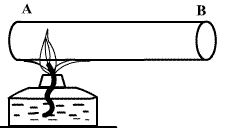
სხეულის (მაგ. აირის) თერმოდინამიკური მდგომარეობა ხასიათდება მისი მასით m, მოლური მასით μ, წნევით P, მოცულობით V, ტემპერატურით T (შეიძლება სხვა სიდიდეებითაც, მაგალითად ისეთებით, რომლებიც განსაზღვრავენ მის ქიმიურ შემადგენლობას). ყველა ამ სიდიდეს სხეულის თერმოდინამიკური პარამეტრები ეწოდება. თუმცა, როგორც შემდგომ გამოჩნდება, ისეთ პარამეტრებს, როგორებიცაა P,V,T, აქვთ აზრი მხოლოდ მაშინ, როცა სხეული თუნდაც მიახლოებულად იმყოფება ე.წ. თერმოდინამიკურ წონასწორობაში (თდწ). ასე ეწოდება მდგომარეობას, რომელშიც ყველა თერმოდინამიკური პარამეტრი დროში რჩება მუდმივი (ამას უნდა დაემატოს სტაციონალური დინებების არ არსებობის პირობაც). თუ, მაგალითად, აირს სწრაფად ვაცხელებთ, როგორც ეს ნაჩვენებია სურათზე, და უშუალო გაცხელების А ნაწილში ტემპერატურა მაღალი აღმოჩნდება В ნაწილის ტემპერატურაზე, მაშინ განსხვავებული იქნება წნევებიც ამ ნაწილებში და მთელი გაზის T ტემპერატურაზე და P წნევაზე საუბარი უაზრობა იქნება. სხვა მაგალითი – შეუშვათ აირში სწრაფი მოლეკულების კონა. ნათელია, რომ აზრი არ აქვს ვისაუბროთ აირის ტემპერატურაზე სანამ სწრაფი მოლეკულები, სხვა მოლეკულებთან დაჯახებების გამო, არ შეიძენენ სხვა მოლეკულების საშუალო სიჩქარის რიგის სიჩქარეებს, ანუ სანამ სისტემა არ მოვა თერმოდინამიკურ წონასწორობაში.
თდწ-ში ყოველი ნივთიერებისთვის თერმოდინამიკური პარამეტრები დაკავშირებულია ერთმანეთთან ე.წ. მდგომარეობის განტოლებით:
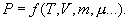 |
(10.1) |
იდეალური აირისთვის ასეთ მდგომარეობის განტოლებას წარმოადგენს კლაპეირონის განტოლება:
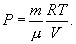 |
(10.2) |
აქ R=8,31 ჯ/(მოლი•კ) – აირის უნივერსალური მუდმივაა, μ - მოლური მასა. ნახშირბადისთვის (С) μ-ს სიდიდე არის 12გრ, წყალბადისთვის (H2) – 2გრ, ჰელიუმისთვის (He) - 4გრ, ჟანგბადისთვის (О2) – 32გრ, წყლისთვის (Н2О) – 18გრ და ა.შ.
ყოველი ნივთიერების ერთი მოლი შეიცავს ერთსადაიმავე რაოდენობის მოლეკულებს N0, რომელსაც ავოგადროს რიცხვი ეწოდება:
| N0=6,02•1028მოლი-1 | (10.3) |
ეს იმით აიხსნება, რომ ყოველი ნივთიერების მოლის მნიშვნელობა ამ ნივთიერების მოლეკულის მასის პროპორციულად არის არჩეული. მოლეკულის მასა შეიძლება მივიღოთ მოლის მასის ავოგადროს რიცხვზე გაყოფით:
 |
(10.4) |
R აირის უნივერსაულური მუდმივას ავოგადროს რიცხვზე განაყოფს (ანუ ერთ მოლეკულაზე მოსულ აირის უნივერსალურ მუდმივას) ბოლცმანის მუდმივა ეწოდება:
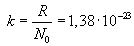 ჯ/კ ჯ/კ |
(10.5) |
(10.2) ფორმულაში შედის ასევე აირის წნევა, მოცულობა, ტემპერატურა და მასა. წნევა Р Si სისტემაში იზომება ნიუტონი კვადრატულ მეტრზე ერთეულით ან პასკალებში (ნ/მ2=პა), მოცულობა V – კუბურ მეტრებში (მ3), მასა m – კილოგრამებში (კგ), ტემპერატურა T – კელვინებში (კ). აბსოლუტური ტემპერატურა Т აითვლება აბსოლუტური ნულიდან (-273,15°С), ანუ Т=t+273,15, სადაც t – ტემპერატურაა ცელსიუსის შკალით.
თუ ნივთიერების რაოდენობა ტოლია ერთი მოლისა, მაშინ (10.2) გარდაიქმნება ასე
 |
(10.6) |
იდეალური ეწოდება აირს, რომელიც იმდენად არის გაუხშოებული, რომ მისი შემადგენელი მოლეკულებისა და ატომების ზომები შეიძლება ჩაითვალოს წერტილოვნად მათ შორის ცარიელ სივრცესთან შედარებით და მათი კინეტიკური ენერგიები კი გაცილებით მეტია მათ შორის დისტანციური ურთიერთქმედების ენერგიასთან. ამ შემთხვევაში ხდება აირის შემადგენელ ნაწილაკებს შორის უშუალოდ დაჯახებითი ურთიერთქმედებების გათვალისწინება. მიუხედავად იმისა, რომ იდეალური აირი არის თეორიული აირი, უმეტეს შემთხვევებში ეს მოდელი საკმაოდ კარგი მიახლოებით აღწერს პროცესებს. სხვა შემთხვევებში თუ აირი საკმაოდ შეკუმშულია, მაგალითად აირის კონდენსირების წერტილის ახლოს ან კრიტიკული (ფაზის ცვლილების) წერტილის ახლოს გამოიყენება ე.წ. რეალური აირის მოდელი და მაშინ ნაცვლად (10.6)-სა გვაქვს
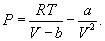 |
(10.7) |
ეს არის რეალური აირის მდგომარეობის განტოლება ან ვან-დერ-ვაალსის განტოლება. აქ a და b პარამეტრებია, რომლებიც დგინდება ცდისეულად ან ხანდახან შეიძლება განისაზღვროს კრიტიკული ტემპერატურითა და კრიტიკული წნევით.